 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2013 年, 第 11 卷, 第 11 篇 doi: 10.5376/mpb.cn.2013.11.0011
收稿日期: 2013年04月21日 接受日期: 2013年04月23日 发表日期: 2013年05月22日
引用格式(中文):
张秀荣等, 2013, 花生Cu/Zn-SOD基因(AhCSD1)克隆及品种间等位多态性分析, 分子植物育种(online), 11(11): 1068-1081 (doi: 10.5376/mpb.cn.2013.11.0011)
引用格式(英文):
Zhang et al., 2013, Cloning and Allelic Polymorphism Analysis of Cu/Zn-SOD Gene (AhCSD1) in Peanut (Arachis hypogaea L.), Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding), 11(11): 1068-1081 (doi: 10.5376/mpb.cn.2013.11.0011)
为明确花生Cu/Zn-SOD基因(AhCSD1)结构及不同基因型种质间遗传多态性,本研究利用同源克隆技术从花生栽培种和花生区组二倍体野生种中获得AhCSD1,并进行生物信息学分析。山花9号AhCSD1序列分析结果表明,两条cDNA序列 rShCSD1-1和rShCSD1-2同源性98.18%,编码区存在10个SNP;对应核DNA序列gShCSD1-1与gShCSD1-2同源性97.08%,共存在64个差异位点,其中27个SNP,两条序列具有3个限制性酶识别位点的差异;两条序列均含有8个外显子和7个内含子。4个栽培品种的rCSD1-2与gCSD1-2序列分别一致;rCSD1-1与gCSD1-1序列同源性分别为99.68%和99.70%;编码区存在6个SNP,引起对应氨基酸序列的第53、第75、第147位残基变异。与野生种序列比对结果显示山花9号gShCSD1-2与B组A.ipaensis的gAipCSD1同源性100%,gShCSD1-1与A组A.duranensis和A.kuhlmannii的gAduCSD1和gAkuCSD1同源性分别为99.89%和99.48%;分子进化分析结果表明gCSD1-1与gCSD1-2分别来自栽培种的A、B两个染色体组;A.ipaensis为栽培种花生B染色体组供体;A.duranensis和栽培种花生的亲缘关系比A.kuhlmannii更近。研究结果为揭示AhCSD1基因结构差异、转录水平与抗旱性的相关性,明确不同花生品种的抗旱机制提供重要参考。
植物正常生长时活性氧(reactive oxygen species, ROS)的产生和清除处于动态平衡状态,但在高温、干旱、盐渍以及病虫害等逆境条件下,ROS过度积累引起细胞膜脂过氧化反应,进而导致DNA、蛋白质及其它细胞组分损伤,严重时致使植物死亡(Apel and Hirt, 2004)。在长期进化过程中,植物形成了由超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等组成的酶促抗氧化防护系统,对清除胁迫条件下积累的ROS,减轻或避免ROS对细胞的伤害起到重要作用(尹永强等, 2007)。
SOD (Superoxide Dismutase, EC 1.15.1.1)作为抵御活性氧介导的氧化损伤的第一道防线,是保护酶体系中的关键酶。在高等植物中SOD可根据其辅基部位结合的不同金属离子主要分为Mn-SOD、Fe-SOD和Cu/Zn-SOD三类,其中Cu/Zn-SOD主要位于细胞质和叶绿体(Huang et al., 2012)。花生SOD同工酶有Cu/Zn-SOD和Mn-SOD两种,且Cu/Zn-SOD活性更稳定,在遭遇环境剧烈变化时能够快速提高酶活性以保护植物免受ROS伤害,是花生SOD活性的最主要组成部分(武宝玕, 1989)。目前,Cu/Zn-SOD相关基因已从多种植物得到分离克隆和表达分析,并应用于提高植物的抗逆性。
SOD活性是花生重要的抗旱性成分(王小纯等, 2002; 姜慧芳和任小平, 2004),不同花生品种应对干旱胁迫时SOD活性变化差异显著(张智猛等, 2013)。以往研究多集中于干旱胁迫下SOD活性变化分析,而对其相关基因水平的研究报道较少。本研究以花生Cu/Zn-SOD基因cDNA序列(GenBank: DQ097721) 为基础,从花生栽培品种与二倍体野生种A.duranensis、A.kuhlmannii和A.ipaensis中克隆细胞质Cu/Zn-SOD基因(AhCSD1),分析其分子生物学特征,明确该基因分子起源,为进一步探究AhCSD1基因响应干旱胁迫以及不同品种间SOD活性差异的分子机理提供依据。
1结果与分析
1.1花生AhCSD1的克隆
对参考序列(DQ097721)分析表明,该cDNA序列与拟南芥细胞质Cu/Zn-SOD基因(CSD1)编码区同源性达78%,推导的氨基酸序列同源性高达81.6%,无明显跨膜结构与信号肽,且活性位点高度保守,故确定该序列为花生细胞质Cu/Zn-SOD基因cDNA序列。通过搜索花生EST数据库将该序列向3'端延伸,在终止密码子下游具有poly(A)加尾信号。
以栽培品种山花9号、ICG6848、农大818和荔浦大花生cDNA为模板,用引物CSD1-F: GCTTCTTTCCCTTCTCAGTCAA和CSD1-R: CACGCGAAAAAGCATGATAATC进行PCR扩增,产物经电泳检测获得550 bp左右特异性条带,与预期大小相符(图1A);4个品种扩增产物回收后经测序均获得2个AhCSD1基因,分别命名(表1)。以栽培品种和二倍体野生种基因组DNA为模板,引物CSD1-F/R进行PCR扩增,电泳结果显示特异性条带长度约2 100 bp (图1B);测序结果表明栽培种分别获得两条同源序列,分别命名(表1)。野生种A.duranensis、A.kuhlmannii和A.ipaensis各获得一条序列,分别命名为gAduCSD1、gAkuCSD1和gAipCSD1。
|
|
 表1 供试花生栽培品种及AhCSD1基因cDNA、氨基酸序列命名 Table 1 Tested peanut cultivars and the corresponding cDNA and amino acid sequence label of AhCSD1 |
1.2山花9号AhCSD1序列分析
1.2.1 cDNA序列分析
由山花9号获得的rShCSD1-1和rShCSD1-2长度均为550 bp,最大开放阅读框(open reading frame, ORF)位于51~509 bp,编码152个氨基酸残基(aa);两条序列同源性为98.18%,共存在10个变异位点,且均位于编码区,其中7个为单核苷酸多态性(single nucleotide polymorphism, SNP)位点,A-G、T-C转换和A-C颠换位点数分别是2个、4个和1个;与参考序列同源性分别为98.00%和99.82%;ATG起始密码子附近符合Kozak规则(AXXATGG)(图2)。
 图2 花生AhCSD1核苷酸序列比对 Figure 2 Alignment of nucleotide sequences of AhCSD1 from peanut |
1.2.2 DNA序列分析
由山花9号获得的两条DNA序列gShCSD1-1和gShCSD1-2长度分别为2 169 bp和2 185 bp,序列同源性97.08%;全序列共存在64个差异位点,其中有27个SNP,占总变异位点的42.19%,转换、颠换、缺失位点数分别为14个、12个和1个(图2)。
Splign分析表明两条序列均含有8个外显子和7个内含子,rShCSD1-1和rShCSD1-2分别与gShCSD1-1和gShCSD1-2外显子部分一致(图2),外显子平均长度均为68 bp;内含子平均长度分别为232 bp和234 bp,内含子Ⅰ最大,长度均为470 bp,内含子Ⅱ最小,长度均为105 bp;两序列在内含子Ⅵ和Ⅶ区域多态性位点丰富,除16个SNP外,分别具有短序列缺失;所有内含子的剪切方式均符合GT/AG规则(图2)。
限制性酶切位点分析发现gShCSD1-1特有XmnⅠ的识别位点,gShCSD1-2特有BamHⅠ和SpeⅠ两种限制性酶的识别位点(图3);且两条序列间差异引起了AhaⅢ (TTT/AAA)、BclⅠ(T/GATCA)、BsiⅠ(C/TCGTG)、DraⅠ(TTT/AAA)、NsiⅠ(ATGCA/T)和SspⅠ(AAT/ATT)六种限制性酶识别位点数目变化。
 图3 山花9号两条AhCSD1部分核苷酸序列比对 Figure 3 Alignment of partial nucleotide sequences of AhCSD1 from Shanhua 9 |
1.2.3推导的氨基酸序列分析
由rShCSD1-1和rShCSD1-2推导的氨基酸序列,分别命名为ShCSD1-1和ShCSD1-2,长度均为152 aa,富含甘氨酸(Gly),分别占氨基酸组成的17.8%和18.4%;两条序列同源性97.37%,存在4个氨基酸差异(图4),与参考序列推导的氨基酸序列同源性分别为96.71%和99.34%。
 图4 花生AhCSD1氨基酸序列分析 Figure 4 Amino acid sequences analysis of AhCSD1 |
生物信息学预测结果显示ShCSD1-1和ShCSD1-2理论分子量(MW)和等电点(pI)分别为15.1 kDa、5.67和15.2 kDa、5.46。ShCSD1-1二级结构含α螺旋3.29%,延伸串34.21%,β转角9.21%,不规则卷曲53.29%;ShCSD1-2含α螺旋5.26%,延伸串33.55%,β转角10.53%,不规则卷曲50.66%;两条序列均无明显跨膜结构,为非分泌蛋白;亚细胞定位预测表明ShCSD1-1和ShCSD1-2均最可能定位于细胞质,总体分值分别为8.7和8.1。
通过NCBI的protein blast功能,CD-Search 工具进行蛋白质保守结构域分析,结果表明ShCSD1具有典型Cu/Zn离子结合位点,属于Cu/Zn-SOD家族。植物Cu/Zn-SOD是同型二聚体,每个亚基均结合有一个铜离子(Cu2+)和一个锌离子(Zn2+)构成酶活性中心。经分析ShCSD1的Cu2+结合位点为His45、His47、His62和His130;Zn2+结合位点为His62、His70、His79和Asp82;并存在Cys56和Cys145形成分子内二硫键共同维持空间结构(图4)。
1.3不同基因型花生AhCSD1遗传多态性分析
1.3.1四个栽培品种AhCSD1等位差异及氨基酸序列分析
对4个栽培品种AhCSD1基因cDNA序列分析结果表明各品种AhCSD1两条cDNA序列长度均为550 bp;其中rShCSD1-2、rIgCSD1-2、rNdCSD1-2和rLpCSD1-2序列完全一致;rShCSD1-1、rIgCSD1-1、rNdCSD1-1和rLpCSD1-1序列同源性99.68%,存在6个SNP,且均位于编码区(表2)。由于密码子的简并性,第368 bp、第386 bp、第485 bp处变异未引起4个品种对应氨基酸序列ShCSD1-1、IgCSD1-1、NdCSD1-1和LpCSD1-1的变化,为同义突变;第219 bp、274 bp、489 bp处变异分别导致品种间第53、第75、第147位氨基酸变化(图4)。
|
表2 花生不同栽培品种AhCSD1基因编码区多态性位点 Table 2 Polymorphism site of AhCSD1 in different cultivars |
DNA序列分析结果表明4个栽培品种AhCSD1基因gShCSD1-2、gIgCSD1-2、gNdCSD1-2和gLpCSD1-2序列完全一致;gShCSD1-1、gIgCSD1-1、gNdCSD1-1和gLpCSD1-1序列同源性99.70%,共存在17处等位变异(图2)。
1.3.2花生栽培种与野生种AhCSD1基因序列分析
由3个二倍体野生种A.duranensis、A.kuhlmannii和A.ipaensis获得的AhCSD1的cDNA序列分别命名为rAduCSD1、rAkuCSD1和rAipCSD1,序列比对结果显示rShCSD1-2与rAipCSD1序列一致;rShCSD1-1与rAduCSD1序列同源性98.73%,存在7个SNP;rShCSD1-1与rAkuCSD1序列同源性98.00%,共存在11处变异,其中9个为SNP (图2)。
利用山花9号AhCSD1两条核苷酸序列与3个二倍体野生种序列构建分子进化树,结果显示gShCSD1-1与A组野生种A.duranensis的序列gAduCSD1聚在一起,又与A组野生种A.kuhlmannii的序列gAkuCSD1聚为一组;gShCSD1-2与B组野生种A.ipaensis的序列gAipCSD1聚在一起(图5)。序列比对结果表明gShCSD1-2与gAipCSD1完全一致;gShCSD1-1与gAduCSD1和gAkuCSD1同源性分别为99.89%和99.48%。因此,gShCSD1-1和gShCSD1-2分别来自山花9号A、B两个染色体组。野生种A.ipaensis为栽培种花生B染色体组供体,A染色体组野生种A.duranensis与栽培种花生亲缘关系比A.kuhlmannii更近。
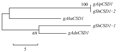 图5 花生AhCSD1分子进化分析 Figure 5 Molecular evolution analysis of AhCSD1 in Arachis |
1.4花生AhCSD1与其他植物细胞质Cu/Zn-SOD序列分析
氨基酸序列比对分析结果表明,山花9号ShCSD1-1与拟南芥(Arabidopsis thaliana, NP_001077494)、烟草(Nicotiana plumbaginifolia, CAA39444.1)、番茄(Solanum lycopersicum, AAA34194.1)、大豆(Glycine max, NP_001235298.1)、棉花(Gossypium hirsutum, ABA00453.1)、水稻(Oryza sativa, AAA33917.1)、玉米(Zea mays, NP_001105335.1)、小麦(Triticum aestivum, ACO90194.1) 细胞质Cu/Zn-SOD序列同源性分别达81%、83%、82%、90%、88%、79%、82%、79%;Cu2+和Zn2+结合位点高度保守(图4),说明不同来源的细胞质Cu/Zn-SOD可能起源于共同祖先,在进化中相当保守。
聚类分析结果显示来自花生四个栽培种的ShCSD1-1、IgCSD1-1、NdCSD1-1和LpCSD1-1聚为一簇,又与ShCSD1-2聚为一组,和大豆聚在一起;单子叶植物水稻、玉米和小麦聚为一组,与植物分类系统对应一致(图6)。
 图6 植物细胞质Cu/Zn-SOD聚类分析 Figure 6 Cluster analysis of plant cytoplasm Cu/Zn-SOD |
2讨论
花生是重要的油料和经济作物,干旱导致的氧化损伤是影响花生产量和质量的首要限制因子,因此选育抗旱良种尤为重要。以往研究表明SOD活性与抗旱性密切相关,在干旱胁迫下不同抗旱性品种间SOD活性变化差异显著(张智猛等, 2013)。花生SOD有Mn-SOD和Cu/Zn-SOD两种,Chen等(2013)人分离的花生类胚素蛋白AhGLP2有类似Mn-SOD的活性响应胁迫,其编码基因同时也上调表达。花生Cu/Zn-SOD活性占SOD总活性80%以上,且比Mn-SOD更稳定,对花生Cu/Zn-SOD的研究为揭示其响应干旱胁迫及其对花生抗旱性的贡献具有重要意义。
基因型决定了其抗旱性状对胁迫反应的敏感程度(Girdthai et al., 2010),干旱条件下花生不同品种SOD活性变化的显著差异可能与其相关基因结构密切相关。本研究对4个栽培品种细胞质Cu/Zn-SOD基因分析结果表明编码区存在等位变异(表2),并引起相应氨基酸残基的变化(图4),这些差异可能导致蛋白空间构型变化进而影响SOD活性水平。赵士诚等(2008)对玉米在胁迫下抗氧化酶活性及其基因表达分析结果显示SOD活性主要受基因转录水平调控。
花生野生种比栽培种具有更强的环境适应和逆境耐受能力,野生种中丰富的抗性基因是栽培种花生不可替代的宝贵资源,因此,探究花生属种间亲缘关系一直以来都受到了研究者的广泛关注。栽培种花生(AABB)为异源四倍体,目前较一致的观点是A.duranensis(AA)和A.ipaensis(BB)为栽培种的祖先种(Moretzsohn et al., 2013)。本研究对花生栽培种和野生种AhCSD1序列分析结果显示山花9号gShCSD1-1和gShCSD1-2分别来自栽培种A、B两个染色体组,并证明了A.ipaensis为栽培种花生B染色体组供体,gShCSD1-1与来自A.duranensis的序列gAduCSD1同源性为99.89%。
花生SOD活性与抗旱性密切相关,抗旱型品种具有更高的SOD活性。然而前人的研究多集中于干旱胁迫下花生不同品种在不同生育期SOD活性的动态变化,而对其相关基因及其转录水平研究较少。因此,本研究对花生细胞质Cu/Zn-SOD基因分子起源、品种间等位基因差异的研究为探究其基因结构差异、转录水平与抗旱性的相关性,明确不同花生品种的抗旱分子机理以及加快花生抗旱育种具有重要意义。
3材料与方法
3.1材料
植物材料为4份栽培品种(表1)和花生区组二倍体野生种A.duranensis、A.kuhlmannii和A.ipaensis。
Plant Genomic DNA Kit、RNAprep Pure Plant Kit、Quant Script RT Kit、TIANgel Midi Purification Kit等均购自天根生化科技有限公司;pEASY-T1 Cloning Kit、大肠杆菌菌株DH5α、Tag酶、dNTP等购自北京全式金生物技术有限公司;引物由上海生物工程有限公司合成,测序工作由北京六合华大基因科技有限公司完成;试验所需其它药品试剂均为国产或进口分析纯。
3.2方法
3.2.1 DNA、RNA提取及cDNA链合成
依据提取试剂盒步骤分别提取花生栽培品种与野生种幼嫩叶片DNA、RNA。以2 μg RNA为模板,Oligo(dT)为引物,依照反转录试剂盒操作说明合成cDNA第一链。
3.2.2 AhCSD1的PCR扩增及测序
以报道序列(DQ097721)为模板,利用Primer5.0结合Oligo6.0软件设计特异性引物CSD1-F:GCTTCTTTCCCTTCTCAGTCAA与CSD1-R:CACGCGAAAAAGCATGATAATC。以cDNA为模板,PCR扩增程序:94℃预变性5 min;95℃变性30 s,54℃退火30 s,72℃延伸30 s,35个循环;72℃后延伸7 min。以DNA为模板,PCR扩增程序:94℃预变性5 min;95℃变性30 s,54℃退火30 s,72℃延伸2 min,35个循环;72℃后延伸10 min。PCR产物经1%琼脂糖凝胶电泳,依据东金玉等(2012)试验方法回收目的片段、送样测序。
3.2.3花生AhCSD1分子生物学特征分析
运用DNAMAN软件进行序列比对和翻译,利用MEGA(Tamura et al., 2011 )软件采用采用最大简约法(Maximum Parsimony, MP)构建栽培种与野生种AhCSD1分子进化树,邻位相连法(Neighbor-Joining, N-J)对Cu/Zn-SOD氨基酸序列进行聚类分析,均用Bootsrap 1 000评估分子树置信度。
利用NCBI在线工具Splign (http://www.ncbi.nlm.nih.gov/sutils/splign/splign.cgi?textpage=online&level=form)
分析基因内含子;CD-Search (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析蛋白保守结构域。蛋白质基本理化性质、二级结构、跨膜结构和亚细胞定位预测运用ProtParam (http://www.expasy.org/),SOPMA (http://pbil.ibcp.fr/htm/index.php),TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)和softberry (http://linux1.softberry.com/berry.phtml)完成。
作者贡献
张秀荣、万勇善、刘风珍是本研究的实验设计和实验研究的执行人;张秀荣完成数据分析,论文初稿的写作;于元杰、张昆参与实验设计,试验结果分析;万勇善、刘风珍是项目的构思者和负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家自然科学基金项目(31201167)、国家现代农业产业技术体系建设专项资金项目(CARS-14)、“十二五”农村领域国家科技计划项目(2011BAD35B04)、山东省花生良种产业化工程项目和山东省现代农业产业技术体系花生创新团队建设项目资助。作者感谢中国农业科学院油料作物研究所姜慧芳研究员提供花生二倍体野生种材料。
参考文献
Apel K., and Hirt H., 2004, Reactive oxygen species: metabolism, oxidative stress, and signal transduction, Annu. Rev. Plant Biol., 55: 373-399
http://dx.doi.org/10.1146/annurev.arplant.55.031903.141701
PMid:15377225
Chen X.P., Wang M.L., Holbrook C., Culbreath A., Liang X.Q., Brenneman T., and Guo B.Z., 2013, Identification and characterization of a multigene family encoding germin-like proteins in cultivated peanut (Arachis hypogaea L.), Plant Molecular Biology Reporter, 29(2): 389-403
http://dx.doi.org/10.1007/s11105-010-0237-6
Dong J.Y., Wan Y.S., and Liu F.Z., 2012, Sequence analysis ofΔ9 stearoy-ACP desaturase gene(SAD)in Peanut, Zuowu Xuebao (Acta Agronomica Sinica), 38(7): 1167-1177 (东金玉, 万勇善, 刘风珍, 2012, 花生Δ9硬脂酰-ACP脱氢酶基因( SAD)的序列分析, 作物学报, 38(7): 1167-1177)
Girdthai T., Jogloy S., Vorasoot N., Akkasaeng C., Wongkaew S., Holbrook C.C., and Patanothai A., 2010, Associations between physiological traits for drought tolerance and aflatoxin contamination in peanut genotypes under terminal drought, Plant Breeding, 129(6): 693-699
http://dx.doi.org/10.1111/j.1439-0523.2009.01738.x
Huang C.H., Kuo W.Y., Weiss C., and Jinn T.L., 2012, Copper chaperone-dependent and-independent activation of three copper-zinc superoxide dismutase homologs localized in different cellular compartments in Arabidopsis, Plant Physiology, 158 (2): 737-746
http://dx.doi.org/10.1104/pp.111.190223
PMid:22186608 PMCid:3271763
Jiang H.F., and Ren X.P., 2004, The effect on SOD activity and protein content in groundnut leaves by drought stress, Zuowu Xuebao (Acta Agronomica Sinica), 30(2): 169-174 (姜慧芳, 任小平, 2004, 干旱胁迫对花生叶片SOD活性和蛋白质的影响, 作物学报, 30(2): 169-174)
Moretzsohn M.C., Gouvea E.G., Inglis P.W., Leal-Bertioli S.C.M., Valls J.F.M., and Bertioli D.J., 2013, A study of the relationships of cultivated peanut (Arachis hypogaea) and its most closely related wild species using intron sequences and microsatellite markers, Annals of Botany, 111(1): 113-126
http://dx.doi.org/10.1093/aob/mcs237
PMid:23131301
Tamura K., Peterson D., Peterson N., Stecher G., Nei M., and Kumar S., 2011, MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods, Molecular Biology and Evolution, 28(10): 2731-2739
http://dx.doi.org/10.1093/molbev/msr121
PMid:21546353 PMCid:3203626
Wang X.C., Ma X.M., Tang F.S., and Zhang X.Y., 2002, Changes of several protective enzyme activities of leaves among different types of kernel of peanut after flowering, Zhiwu Shenglixue Tongxun (Plant Physiology Communications), 38(6): 572-574 (王小纯, 马新明, 汤丰收, 张新友, 2002, 不同粒型品种花生开花后叶片中几种保护酶活性的变化, 植物生理学通讯, 38(6): 572-574)
Wu B.G., 1989, Characteristics and distributions of isozymes of superoxide dismutase in leaf cells of peanut and wheat, Zhiwu Xuebao (Journal of Integrative Plant Biology), 31(11): 854-859 (武宝玕, 1989, 小麦和花生叶细胞内超氧物歧化酶(SOD)同工酶的特性和分布, 植物学报, 31(11): 854-859)
Yin Y.Q., Hu J.B., and Deng M.J., 2007, Latest development of antioxidant system and responses to stress in plant leaves, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 23(1): 105-110 (尹永强, 胡建斌, 邓明军, 2007, 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展, 中国农学通报, 23(1): 105-110)
Zhang Z.M., Dai L.X., Song W.W., Ding H., Ci D.W., Kang T., Ning T.Y., and Wan S.B., 2013, Effect of drought stresses at different growth stages on peanut leaf protective enzyme activities and osmoregulation substances content, Zuowu Xuebao (Acta Agronomica Sinica), 39(1): 133-141 (张智猛, 戴良香, 宋文武, 丁红, 慈敦伟, 康涛, 宁堂原, 万书波, 2013, 干旱处理对花生品种叶片保护酶活性和渗透物质含量的影响, 作物学报, 39(1): 133-141)
Zhao S.C., Sun J.W., Ma Y.Z., Wang H., Liang G.Q., and Zhou W., 2008, Effects of cadmium on reactive oxygen species metabolism, activities and gene expressions of superoxide dismutase and catalase in maize (Zea Mays) seedling, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 41(10): 3025-3032 (赵士诚, 孙静文, 马有志, 汪洪, 梁国庆, 周卫, 2008, 镉对玉米幼苗活性氧代谢、超氧化物歧化酶和过氧化氢酶活性及其基因表达的影响, 中国农业科学, 41(10): 3025-3032)
